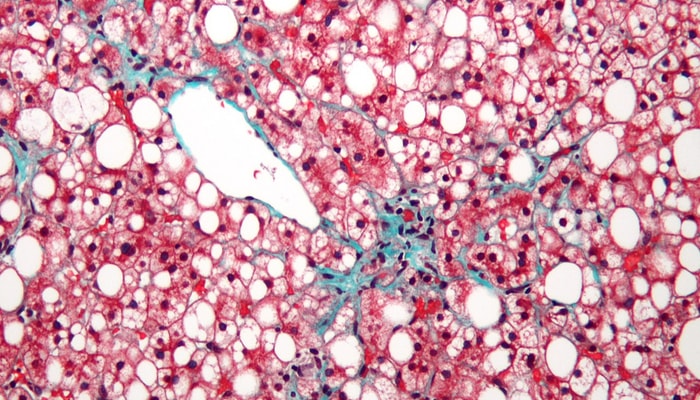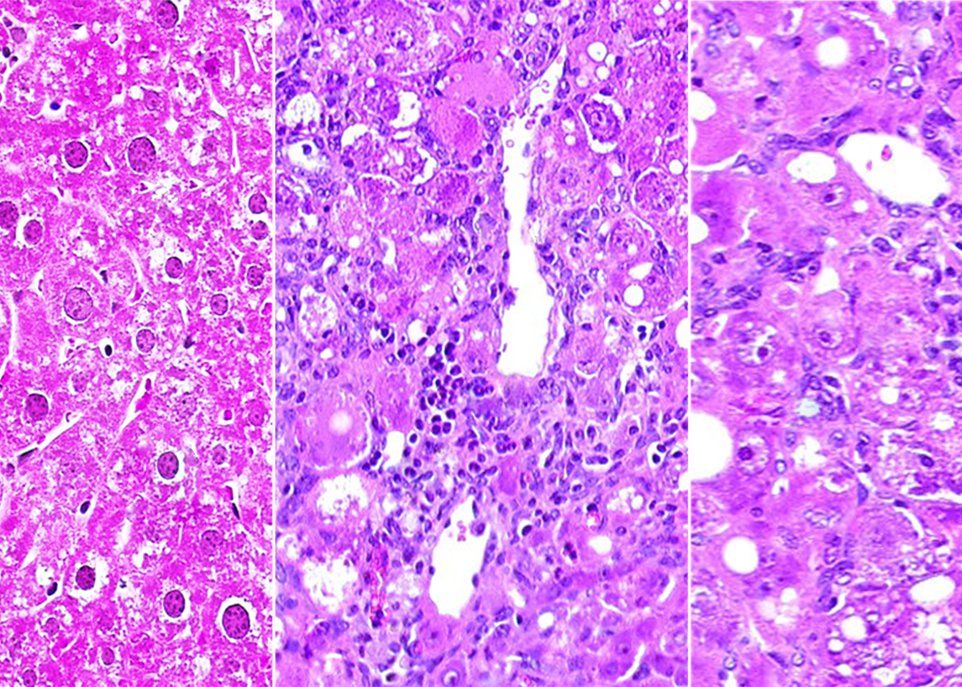
L'image de gauche montre un foie de souris tyrosinémique traitée avec le médicament NTBC. Les deux autres images montrent des lésions hépatiques qui apparaissent quatre semaines et huit semaines après l'arrêt du traitement. De tels changements sont détectés dès la première semaine avec certains miARN.
— Jean-Yves Scoazec et Nicolas Gadot
La tyrosinémie héréditaire est causée par des mutations dans le gène qui code pour une enzyme appelée FAH. Cette enzyme intervient dans la dégradation de la tyrosine, un acide aminé abondant dans l'alimentation courante. Chez les personnes atteintes de tyrosinémie, le mauvais fonctionnement de la FAH conduit à l'accumulation dans les cellules du foie de fumarylacétoacétate (FAA), un métabolite toxique normalement dégradé en composés inoffensifs par la FAH. Le FAA endommage les cellules du foie et peut conduire au développement de cirrhoses et de cancers. Pour éviter d'en arriver là, les personnes atteintes doivent adopter un régime alimentaire faible en protéines et prendre un médicament, le NTBC. Lorsque ces mesures ne suffisent plus, la transplantation du foie doit être envisagée.
En dépit de ces traitements, des tumeurs au foie apparaissent chez une partie des personnes tyrosinémiques. C'est la raison pour laquelle on les soumet régulièrement à des examens par imagerie médicale et à des tests sanguins mesurant la présence d'alphafoetoprotéine (AFP), un marqueur de l'évolution de la maladie. «Le problème est que 80% des petites tumeurs ne sont pas associées à des niveaux anormaux d'AFP et que l'imagerie médicale n'est pas assez sensible pour détecter de petites lésions du foie, souligne Robert Tanguay. On s'est donc demandé s'il y avait moyen de faire mieux.»
Le chercheur de l'Institut de biologie intégrative et des systèmes (IBIS) et ses collaborateurs se sont donc tournés vers les microARN (miARN). «Nos travaux antérieurs sur les maladies cardiovasculaires, ainsi que de nombreuses études menées par d'autres chercheurs, suggèrent que ces molécules peuvent servir de marqueurs pour certaines pathologies», explique-t-il. Les miARN sont de courts segments d'ARN complémentaires aux ARN messagers. Lorsqu'ils se fixent à ces derniers, ils empêchent leur traduction en protéines.
À l'aide de souris de laboratoire qui développent les principales manifestations de la tyrosinémie dès qu'on les prive de NTCB, les chercheurs ont démontré que plus de 300 miARN sont sous-exprimés ou sur-exprimés lorsque la maladie s'enclenche. Du nombre, ils en ont repéré deux – miR-98 et miR-200b – qui sont présents dans le sang et qui ont pour cibles des protéines associées à la tyrosinémie chez ces souris. «Nos analyses montrent que leur expression est modifiée considérablement une semaine à peine après l'arrêt de NTBC, ce qui n'est pas le cas pour le marqueur actuel de la maladie, l'AFP, observe le professeur Tanguay. Les miARN pourraient donc permettre de détecter plus tôt les premières manifestations de la maladie à partir d'un simple échantillon de sang.»
La prochaine étape consiste à déterminer si miR-98 et miR-200b, ou d'autres miARN, pourraient servir de marqueurs de la maladie chez l'humain. «Nous avons commencé à travailler là-dessus grâce au soutien financier de la Fondation Go de Pierre Lavoie, souligne le chercheur. Pour y arriver, nous devons analyser des échantillons de sang provenant de personnes atteintes de tyrosinémie dont l'état est stable et des échantillons prélevés sur des personnes chez qui la maladie a progressé.»
La tyrosinémie héréditaire est une maladie génétique rare qui frappe une personne sur 100 000 dans le monde. Au Québec, sa fréquence est d'une sur 16 000 et elle atteint même une sur 600 au Saguenay–Lac-Saint-Jean. L'étude publiée dans Scientific Reports est signée Francesca Angileri, Geneviève Morrow, Vincent Roy et Robert Tanguay, de la Faculté de médecine et de l'IBIS, Suli Huang et Tangchun Wu, de la Huazhong University of Science and Technology, et Jean-Yves Scoazec et Nicolas Gadot, de l'Université de Lyon.