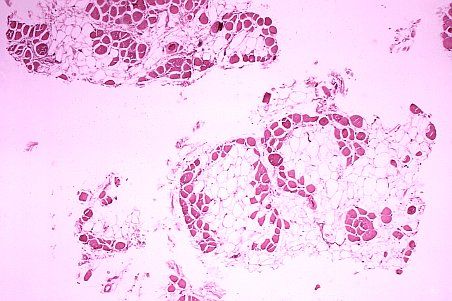
Chez les patients atteints de dystrophie musculaire de Duchenne, les fibres musculaires (mauves) s'atrophient et sont remplacées par des cellules adipeuses (translucides). L'ostéoprotégérine pourrait prévenir ce type de dommages.
— Edwin P. Ewing, Jr / CDC
Plusieurs observations suggéraient l'existence d'un mécanisme liant le métabolisme des os et celui des muscles. Par exemple, un séjour prolongé dans l'espace cause à la fois une atrophie des muscles et une résorption des os chez les astronautes. À l'inverse, les stéroïdes anabolisants entraînent une hypertrophie musculaire et une augmentation de la densité osseuse chez ceux qui en font usage. Jusqu'à présent, le mécanisme qui gouvernait cette communication croisée os-muscle demeurait inexpliqué, mais les chercheurs croient maintenant que l'OPG pourrait en être la clé.
L'existence de cette protéine dans le tissu osseux et les rôles qu'elle y joue sont connus depuis 15 ans. Chez les animaux de laboratoire, la sous-expression d'OPG entraîne l'ostéoporose, alors que sa surexpression augmente la densité osseuse. Les réponses parallèles des os et des muscles observées chez les personnes atteintes de certaines maladies, notamment la dystrophie musculaire de Duchenne, ont donné l'idée aux chercheurs d'aller voir si l'OPG était aussi produite par les muscles.
Les tests in vitro qu'ils ont menés sur des muscles de souris indiquent que cette protéine est effectivement synthétisée par certaines cellules musculaires. Les chercheurs ont ensuite testé l'effet de cette protéine sur des souris qui présentent les mêmes déficiences biochimiques que les personnes atteintes de dystrophie musculaire de Duchenne. Des injections quotidiennes d'OPG pendant 10 jours ont accru la force des contractions de 60 à 230%, selon les muscles étudiés, comparativement aux souris dystrophiques qui n'avaient pas reçu le traitement. «L'un des trois muscles testés a même retrouvé une force comparable à celle de souris normales, précise le responsable de l'étude, Jérôme Frenette. Les examens microscopiques des muscles ont également révélé que l'OPG réduit les dommages structuraux et l'inflammation causés par la maladie.»
Selon le chercheur, cette découverte pourrait être majeure parce qu'elle ouvre de nouvelles avenues thérapeutiques non seulement pour la dystrophie musculaire de Duchenne, mais aussi pour d'autres maladies des muscles ainsi que pour l'ostéoporose puisqu'elle agit sur les deux tableaux. Le professeur Frenette et son collègue Josef Penninger ont obtenu un brevet pour l'utilisation de l'OPG dans le traitement des maladies des muscles et du coeur. «L'OPG a déjà fait l'objet d'études cliniques pour le traitement de l'ostéoporose et elle ne posait pas de problème de toxicité chez l'humain. Si nous obtenons la collaboration d'une entreprise pharmaceutique, nous pourrions passer rapidement à des études cliniques sur des personnes atteintes de maladies musculaires», souligne-t-il.
La Duchenne Alliance, un regroupement international de 40 fondations engagées dans la lutte contre la dystrophie musculaire de Duchenne, a invité le professeur Frenette à présenter ses travaux à Boston la semaine dernière. «Ces fondations rejoignent des milliers de personnes qui ont des enfants atteints de dystrophie musculaire. La pression que les fondations et les parents peuvent exercer sur les compagnies pharmaceutiques risque de faire bouger les choses très rapidement», croit le professeur Frenette.
L'étude publiée dans l'American Journal of Pathology est signée par Sébastien Dufresne, Nicolas Dumont, Patrice Bouchard, Éliane Lavergne et Jérôme Frenette, du CHU de Québec et du Département de réadaptation, et par leur collègue Josef Penninger, de l'Austrian Academy of Sciences.