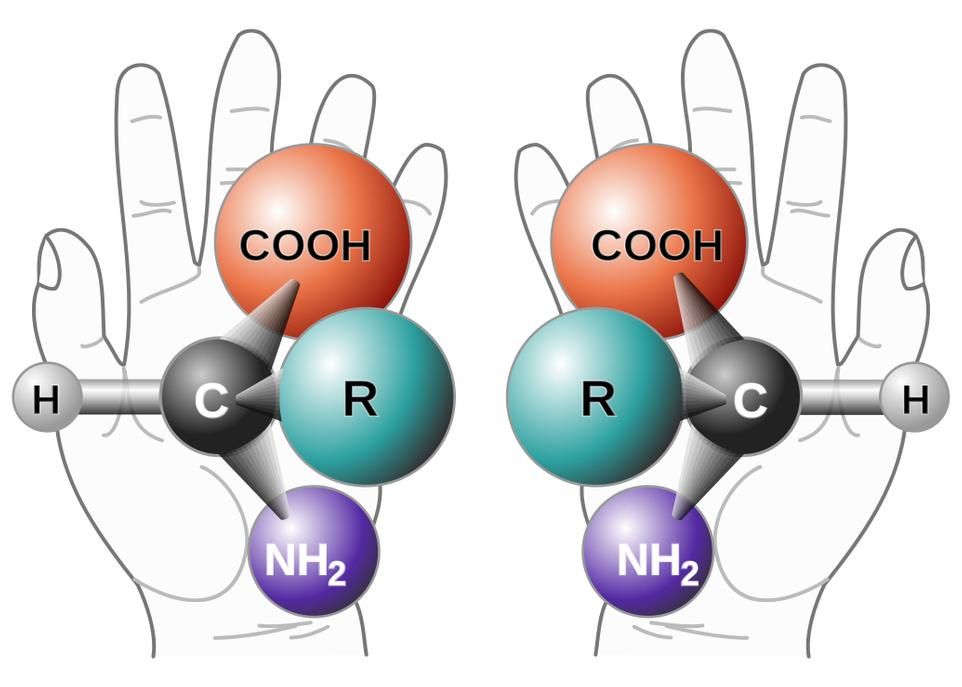
Les composés chiraux existent sous deux formes parfaitement identiques, dont l'une est l'image miroir de l'autre, comme la main gauche et la main droite. Ce caprice de la nature a des répercussions qui sont parfois anodines, mais parfois très graves. Les industries ont donc tout intérêt à bien maîtriser la forme des composés qu'elles synthétisent et mettent en marché.
— Illustration NASA
Rappelons que la chimie des surfaces s'intéresse aux interactions entre des composés chimiques et une surface agissant comme catalyseur. Elle présente deux avantages majeurs par rapport à la chimie classique. D'une part, elle ne nécessite pas d'étape finale pour séparer les produits et le catalyseur et, d'autre part, elle permet de récupérer et de réutiliser le catalyseur, ce qui revêt un intérêt économique certain pour l'industrie. «La chimie des surfaces est très couramment utilisée dans les procédés industriels, même si on ne comprend pas encore très bien comment elle fonctionne», souligne Peter McBreen, professeur au Département de chimie.
Le professeur McBreen et ses collaborateurs étudient la chimie des surfaces afin de mieux en comprendre les mécanismes réactionnels et aussi parce qu'elle pourrait servir à améliorer la synthèse de certaines molécules dites chirales. Ces composés existent sous deux formes parfaitement identiques, dont l'une est l'image miroir de l'autre, comme la main gauche et la main droite. Ce caprice de la nature a des répercussions qui sont parfois anodines – un composé sent l'orange sous une forme et le citron sous l'autre –, mais qui peuvent être parfois très graves. C'est le cas de l'éthambutol, un antibiotique utilisé pour traiter la tuberculose, qui, sous sa forme miroir, peut causer la cécité.
Les industries ont donc tout intérêt à bien maîtriser la forme des composés qu'elles synthétisent et mettent en marché. Pour y arriver en utilisant la chimie des surfaces, les chimistes déposent une molécule guide sur la surface qui sert de catalyseur et ils les mettent en contact avec des réactifs en solution. En théorie, la molécule guide se lie à un réactif et le force à adopter une orientation spécifique par rapport à la surface du catalyseur, ce qui favorise la production de la forme chirale souhaitée. Pour déterminer si c'est bien ainsi que les choses se passent, le professeur McBreen et ses étudiants-chercheurs Guillaume Goubert, Yi Dong et Jean-Christian Lemay ont fait appel à la microscopie à effet tunnel. «Les images que nous avons obtenues permettent de visualiser directement les interactions entre un réactif et une molécule guide. Elles montrent que, contrairement à l'idée reçue, les deux molécules ne s'assemblent pas dans une position fixe. Elles ont plusieurs façons de se lier et elles passent d'une configuration à une autre, résume Peter McBreen. Les chimistes soupçonnaient que ça pouvait être le cas, mais notre étude en apporte une preuve visuelle.»
Selon le chercheur, cette démonstration constitue une avancée importante dans la compréhension des mécanismes intervenant en chimie des surfaces. «Pour l'instant, nos travaux ont surtout un intérêt fondamental, mais ils ouvrent la porte à de nouvelles façons de contrôler la synthèse de composés chiraux. On pourrait, par exemple, modifier la molécule guide de façon à permettre uniquement les assemblages désirés avec un réactif donné. De cette façon, on pourrait mieux contrôler la forme chirale produite par la réaction.»
L'article paru dans Nature Chemistry est également signé par Michael N. Groves et Bjørk Hammer, de l'Université d'Aarhus au Danemark.
Les images obtenues par l'équipe de Peter McBreen à l'aide d'un microscope à effet tunnel permettent de visualiser directement les interactions entre un réactif et une molécule guide sur une surface de platine. Elles montrent que, contrairement à l'idée reçue, les deux molécules ne s'assemblent pas dans une position fixe. Elles ont plusieurs façons de se lier et elles passent d'une configuration à une autre.