2 août 2024
Des chercheurs établissent la structure d'une protéine jouant un rôle clé dans la réparation et la transcription de l'ADN
Cette découverte, publiée dans Science par des équipes de l'Université Laval et de l'Université de la Californie, laisse entrevoir de nouvelles pistes de traitement pour le cancer et l'alzheimer
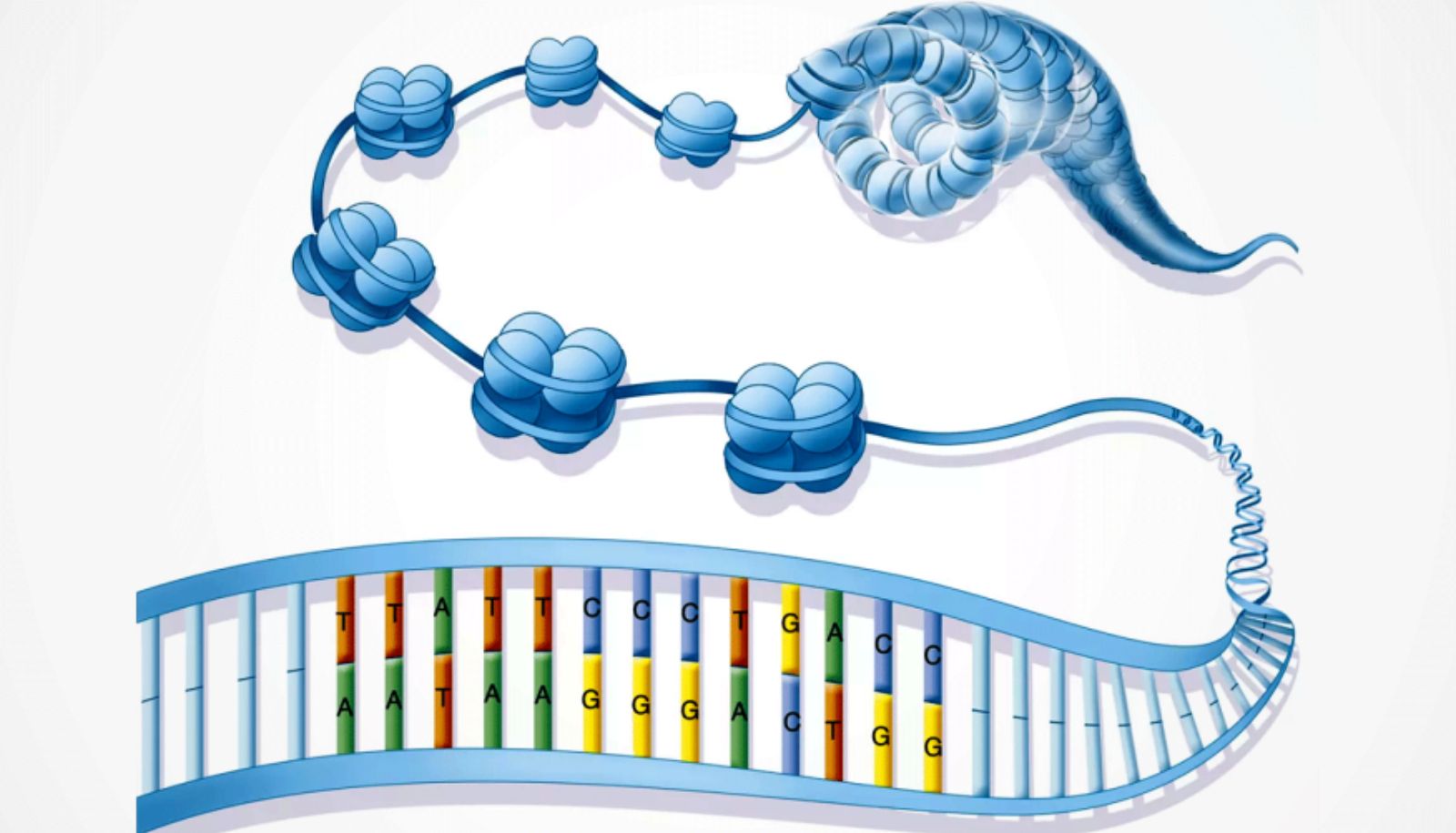
Cette illustration montre comment le double brin d'ADN s'enroule périodiquement autour de groupes de 8 petites protéines, appelées histones, créant un effet de collier de perles. La protéine TIP60 déstabilise les interactions entre l'ADN et les histones. Les ouvertures ainsi créées permettent aux enzymes qui réparent ou qui transcrivent l'ADN de faire leur travail.
— Getty Images
Que ce soit pour transcrire l'information contenue dans nos gènes ou pour réparer les dizaines de cassures qui surviennent quotidiennement dans notre ADN, nos enzymes doivent pouvoir accéder directement à l'ADN pour accomplir leurs fonctions. Or, dans le noyau cellulaire, cet accès est limité par de petites protéines, appelées histones, autour desquelles s'enroulent des sections du brin d'ADN, donnant à l'ensemble l'allure d'un collier de perles.
Des chercheurs de l'Université Laval et de l'Université de la Californie à Berkeley viennent de réaliser une percée importante en établissant la structure détaillée d'un complexe protéique dont la fonction est, justement, de créer des brèches vers l'ADN. «Ce complexe, appelé TIP60, déstabilise les interactions entre l'ADN et les histones, ce qui crée des ouvertures jusqu'à l'ADN», explique Jacques Côté, professeur à la Faculté de médecine de l'Université Laval, chercheur au Centre de recherche du CHU de Québec – Université Laval et coresponsable d'une étude sur le sujet qui vient de paraître dans Science.
Les chercheurs sont parvenus à élucider la structure de ce complexe formé de 17 protéines et à documenter les interactions entre ses composantes grâce à diverses approches, mais tout particulièrement grâce à la cryomicroscopie électronique à haute résolution. Cette technologie, qui a valu le prix Nobel de chimie à trois scientifiques en 2017, permet de décoder la structure atomique des protéines.
«La cryomicroscopie électronique à haute résolution permet d'étudier la structure moléculaire de systèmes biologiques complexes tels que les protéines, ce qu'aucune autre méthode ne permettait auparavant, explique le professeur Côté. Les échantillons de protéines sont congelés rapidement dans l'éthane liquide de manière à les figer dans leur état natif. Les images produites ont une résolution qui se situe sous les 3 angströms (3 X 10-10 m). On peut donc voir les protéines à l'échelle atomique. Ce développement a entraîné une explosion de publications dans le domaine de la structure des protéines au cours des dernières années.»
Pour élucider la structure de TIP60, le professeur Côté s'est associé à la professeure Eva Nogales, de l'Université de la Californie à Berkeley. «Nous lui avons fait parvenir des fractions purifiées de TIP60 préparées dans notre laboratoire. La professeure Nogales a non seulement accès à l'équipement spécialisé requis pour réaliser ce genre d'analyses, mais son expertise en cryomicroscopie électronique à haute résolution est reconnue mondialement», souligne-t-il.
Le mauvais fonctionnement de TIP60 est associé à plusieurs types de cancer, notamment le cancer du colon, du poumon, du sein, du pancréas, de l'estomac et des mélanomes métastatiques. Il est aussi associé à des troubles neurologiques comme l'alzheimer et les syndromes neurodéveloppementaux.
«Lorsque l'accès à l'ADN est restreint, les enzymes qui assurent la réparation des cassures d'ADN ne peuvent pas fonctionner, et des dommages cellulaires importants peuvent survenir. Le même problème peut se produire avec les gènes suppresseurs de tumeurs. Pour qu'ils soient exprimés, il faut que TIP60 puisse créer une ouverture jusqu'à l'ADN», rappelle le professeur Côté.
Une bonne connaissance de la structure de TIP60 est indispensable si l'on espère développer de nouvelles thérapies ciblées, enchaîne-t-il. «Certaines maladies, notamment l'alzheimer, sont associées à de faibles niveaux de TIP60. Pour ces maladies, on pourrait développer des molécules qui se lient aux sites actifs de TIP60 afin de l'activer. Une étude a démontré que cette approche pouvait réactiver la mémoire cognitive de souris transgéniques utilisées pour étudier l'alzheimer.»
— Jacques Côté
Pour les cancers, on pourrait, à l'inverse, souhaiter inhiber localement l'activité de TIP60, poursuit le professeur Côté. «En administrant des inhibiteurs de TIP60 dans les tissus touchés par le cancer, on pourrait ralentir localement la multiplication des cellules cancéreuses. Pour le moment, il n'y a pas de bons inhibiteurs de TIP60. Maintenant que la structure de ce complexe est connue, nous espérons que les choses vont débloquer.»
La première coauteure de l'étude parue dans Science est la doctorante Amel Mameri. Les autres signataires de l'Université Laval sont Catherine Lachance, Jonathan Humbert, Deepthi Sudarshan, Maxime Galloy, Amélie Fradet-Turcotte, Jean-Philippe Lambert et Jacques Côté.