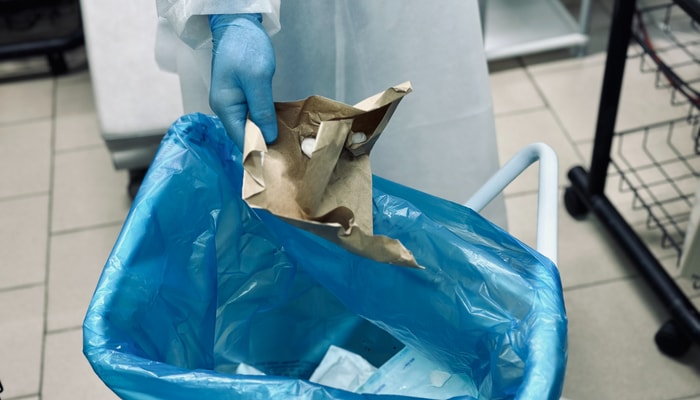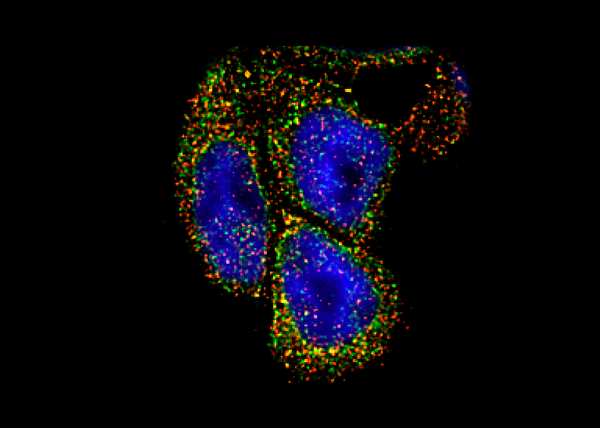
Les nouvelles protéines UGT, en rouge, sont en contact avec les enzymes UGT, en vert, dans les cellules humaines, modulant ainsi l'activité de détoxification de ces enzymes. Les points de contact apparaissent en jaune.
— Yannick Audet-Delage
Chez l'humain, il existe 10 gènes qui codent pour les enzymes UGT. Ces gènes assurent l'expression de 19 enzymes, dont la plupart interviennent dans l'élimination des médicaments et des toxines. «Elles ajoutent un acide glucuronique à ces composés, ce qui les rend inactifs et en augmente la solubilité. Ce faisant, elles empêchent leur réabsorption dans les tissus et favorisent leur élimination par l'urine ou la bile, explique la professeure Guillemette. Environ 35% de tous les médicaments et 55% des 200 médicaments les plus prescrits sont dégradés par les UGT. Elles peuvent donc expliquer, en partie, les variations interindividuelles dans l'efficacité et dans la toxicité des médicaments.»
Les quelque 160 nouvelles variantes de ces enzymes ont été découvertes dans des tissus humains tels que le foie, les reins, l'intestin et le côlon, grâce à des outils de séquençage à haut débit. «Elles sont produites à partir des 10 mêmes gènes, mais la traduction des ARN messagers se fait différemment, ce qui conduit à la synthèse de ces variantes, qui représentent entre 20 et 60% de l'ensemble des produits des gènes UGT. C'est loin d'être marginal», souligne-t-elle.
Ces nouvelles variantes moduleraient la capacité d'inactivation des médicaments par les cellules. «Il semble que les gènes UGT expriment des enzymes pour inactiver ces molécules et, en même temps, des régulateurs de ces enzymes», constate la professeure Guillemette. Les travaux de son équipe ont aussi démontré que la production de ces variantes est amplifiée dans les tissus cancéreux. «Comme les nouvelles UGT sont associées à des perturbations de la synthèse des constituants de base de la cellule, notamment les acides aminés et les nucléotides, ainsi qu'à des perturbations de l'adhésion et de la prolifération cellulaire, elles pourraient également influencer l'évolution de certaines tumeurs.»
La portée clinique de cette découverte est difficile à apprécier pour l'instant, mais elle laisse entrevoir de nouvelles avenues intéressantes. «En intervenant sur le taux de formation de ces variantes, on pourrait favoriser ou prévenir l'élimination de certaines molécules, avance la chercheuse. Il faudra désormais prendre en considération le rôle de ces UGT dans l'utilisation et dans le développement de médicaments ou de traitements contre le cancer.»
L'article paru dans Cell Reports est signé par Michèle Rouleau, Alan Tourancheau, Camille Girard-Bock, Lyne Villeneuve, Jonathan Vaucher, Anne-Marie Duperré, Yannick Audet-Delage, Isabelle Gilbert, Ion Popa, Arnaud Droit et Chantal Guillemette.